C.M. Waltmans – den Breejen en N.J. Verkaik
Algemene inleiding
Principes infectiepreventie
Algemene voorzorgsmaatregelen
Handhygiëne
Isolatiemaatregelen en persoonlijke beschermingsmiddelen
Reiniging en desinfectie
Bijzonder resistente micro-organismen (BRMO)
MRSA
ESBL
CPE
Pseudomonas BRMO
VRE
Overige BRMO
Infectiepreventie op kinderafdeling en NICU: een uitdaging
Algemene inleiding
Florance Nightingale (1820-1910) zag, nog voordat bekend was wat bacteriën zijn, het belang al in van infectiepreventie maatregelen als reinigen van wonden en schoonhouden van omgeving (Gill, 2005). Ook gynaecoloog Semmelweis concludeerde al in 1850 dat handenwassen het aantal gevallen van kraamvrouwenkoorts drastisch kon verminderen (Gill, 2005). Door de toenemende kennis rondom infectiepreventie was het aantal infecties rond 1900 lager dan rond 1800, maar hospital acquired infecties als tuberculose, pneumonie, wondinfecties/gangreen en dysenterie zorgden nog steeds voor een hoge mortaliteit (Smith, 2012). In 1928 ontdekte de Schotse bacterioloog Alexander Fleming penicilline. De incidentie van streptokokken infecties in ziekenhuizen daalde in de dertiger jaren en penicilline werd op grote schaal ingezet voor de behandeling van soldaten in de Tweede Wereldoorlog. Echter, onder andere gebruik van dit middel zorgde in de vijftiger jaren voor een opmars van de bacterie Staphylococcus aureus. Ernstige epidemieën van stafylokokken infecties, waaronder huid infecties, pneumonieën en furunkels, werden beschreven in zowel Europese als Amerikaanse ziekenhuizen (Smith, 2012). Er vond een snelle verspreiding van penicilline resistentie plaats en voor het eerst verschenen formele infectiepreventie programma’s. De Nederlandse overheid verzocht de Gezondheidsraad een rapport op te stellen over de preventie en bestrijding van ziekenhuisinfecties. Het eerste rapport verscheen in 1966 en heeft geresulteerd in een uitgebreid stelsel van wet- en regelgeving met betrekking tot hygiëne en infectiepreventie (Koeleman, 1999). Ook werd in 1980, op initiatief van de Vereniging voor Infectieziekten (VIZ), de Werkgroep Infectie Preventie (WIP) opgericht. In de WIP werkt de VIZ samen met de Nederlandse Vereniging voor Medische Microbiologie (NVMM) en de Vereniging voor Hygiëne en Infectiepreventie in de Gezondheidszorg (VHIG, vereniging van deskundigen infectiepreventie). De WIP heeft als doel de infectiepreventie in Nederland te bevorderen en stelt hiertoe landelijke richtlijnen op voor de preventie van infecties. Vele Infectiepreventie richtlijnen in ziekenhuizen en andere zorginstellingen zijn een kopie of afgeleide van de WIP-richtlijn. Helaas is er anno 2017 omwille van financiële redenen sprake van een voorgenomen opheffing van de WIP. Ondanks dit voornemen worden de WIP-richtlijnen nog wel als professionele standaarden gezien en wordt er door de minister van VWS en de Inspectie voor de Gezondheidszorg toezicht gehouden op basis van deze richtlijnen.
Afdelingen (Hygiëne en) Infectiepreventie, gebruiken samen met de zorgverleners, de richtlijnen om ziekenhuisinfecties te voorkomen en transmissie van micro-organismen tegen te gaan. Andere taken van een afdeling Infectiepreventie zijn:
- Geven van voorlichting en scholing over infectiepreventie
- Adviseren en auditeren op het gebied van hygiëne en infectiepreventie
- Opsporen, registreren en analyseren van ziekenhuisinfecties (‘surveillance’)
- Coördineren van infectiepreventie maatregelen bij een uitbraak met een besmettelijke ziekte ‘outbreakmanagement’
- Isolatieadvies bij (potentieel) besmettelijke patiënten
terug naar boven
Principes infectiepreventie
Algemene voorzorgsmaatregelen
Infectiepreventie is gericht op het voorkomen van transmissie van micro-organismen. Dit wordt bewerkstelligd door ‘algemene voorzorgmaatregelen’ toe te passen, zo nodig aangevuld met isolatiemaatregelen. Dit betreft basismaatregelen die door alle medewerkers moeten worden toegepast bij het verrichten van patiëntenzorg en bij het omgaan met patiënten materiaal. Ze zijn gebaseerd op landelijke richtlijnen die zijn vastgesteld door de WIP. Deze maatregelen bestaan uit persoonlijke hygiëne maatregelen (o.a. nagels kort knippen, geen sieraden dragen aan handen en polsen, dragen van schone dienstkleding), juiste omgang met besmette materialen en handhygiëne.
terug naar boven
Handhygiëne
Handhygiëne is de belangrijkste algemene voorzorgsmaatregel. In een groot aantal studies is het belang van handhygiëne aangetoond (Pittet, 2001; Larson, 2005; Pittet, 1999).. Handhygiëne kan betrekking hebben op handreiniging met water en zeep of handdesinfectie met handalcohol. Handdesinfectie met handalcohol heeft de voorkeur. Hiermee wordt een sterkere reductie in bacterie load bereikt (WHO guidelines, Mackenbach, 2007) en het is daarnaast makkelijk, snel en op elke plaats uitvoerbaar. Echter, in de volgende gevallen moeten handen worden gewassen met water en vloeibare zeep:
- voor aanvang van de werkzaamheden
- na toiletbezoek
- bij zichtbare verontreiniging of als de handen plakkerig aanvoelen
- bij infecties met micro-organismen die resistent zijn tegen alcohol; hieronder vallen Clostridium difficile en gastro-enteritis virussen (noro, adeno, astro en rota).
De momenten waarop handhygiëne moet plaatsvinden zijn gedefinieerd door de WHO (figuur 1):
- Voor patiëntencontact. Rationale: beschermen van patiënt tegen micro-organismen op handen van zorgverlener
- Voor een aseptische behandeling. Rationale: beschermen van patiënt tegen micro-organismen, ook van patiënt zelf
- Na blootstelling aan lichaamsvloeistof. Rationale: beschermen van zorgverlener en omgeving tegen micro-organismen van de patiënt
- Na patiëntencontact. Rationale: beschermen van zorgverlener en omgeving tegen micro-organismen van de patiënt
- Na contact met patiëntomgeving. Rationale: beschermen van zorgverlener en omgeving tegen micro-organismen van de patiënt
Handhygiëne moet ook toegepast worden voor én na het uittrekken van handschoenen. Het dragen van handschoenen is geïndiceerd:
- Bij (mogelijk) in contact komen van de handen met bloed of andere lichaamsvloeistoffen of materialen die hiermee gecontamineerd zijn.
- Bij in contact komen van de handen met slijmvliezen of niet-intacte huid of materialen die hiermee in aanraking zijn geweest.
- Patiënten bij wie het dragen van handschoenen voorgeschreven is (invasieve ingrepen, isolatie).
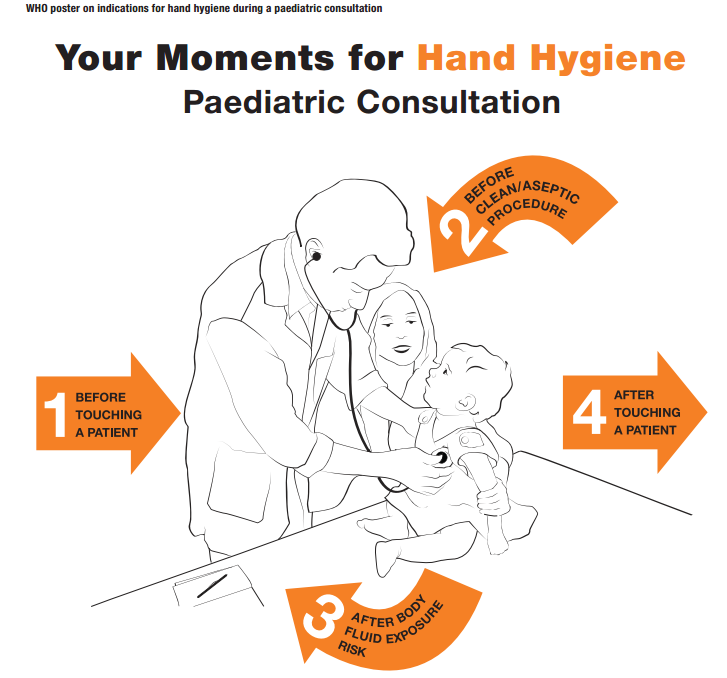
Figuur 1. WHO momenten van hand hygiëne bij onderzoek van een kind. Let op: ook na aanraken van de patiënt omgeving dient er handhygiëne toegepast te worden. Figuur gekopieerd van WHO Paediatric Consultation.
Isolatiemaatregelen en persoonlijke beschermingsmiddelen
Bronisolatie
In veel gevallen kan verspreiding van micro-organismen binnen het ziekenhuis worden voorkomen door algemene voorzorgsmaatregelen toe te passen. Wanneer deze maatregelen ontoereikend zijn, is isolatie van de patiënt geïndiceerd, ter bescherming van de medepatiënten en ziekenhuismedewerkers. Deze vorm van isolatie wordt bronisolatie genoemd. Welke vorm dient te worden toegepast is afhankelijk van de verspreidingsweg van het micro-organisme (tabel 1).
Persoonlijke beschermingsmiddelen
Bij isolatiemaatregelen horen ook de in kolom 4 van tabel 1 genoemde persoonlijke beschermingsmiddelen voor zorgmedewerkers. FFP staat voor ‘Filtering Facepiece Particals ’. Het toegevoegde getal (FFP 1 of 2) drukt de mate uit waarin een masker de lucht die wordt ingeademd filtert van deeltjes van een bepaalde grootte, waaronder micro-organismen. Hoe hoger het getal hoe meer de lucht die wordt ingeademd wordt gefilterd en hoe meer bescherming het ademhalingsbeschermingsmasker biedt. Bij transmissie via aërosolen (bijvoorbeeld bij tuberculose) moet door een medewerker een FFP2 masker gedragen worden (WIP-richtlijn Persoonlijke Beschermingsmiddelen). Bij transmissie via druppels (bijvoorbeeld influenza) volstaat een FFP1 masker. Een praktische reden om niet altijd een FFP2 masker te dragen is dat ademhalen door een dergelijk masker moeilijker gaat dan door een FFP1 masker. In de volgende gevallen moet een chirurgisch mond-neus masker gedragen worden: 1. indien de mond en neus van de medewerker in contact kunnen komen met lichaamsvloeistof van de patiënt 2. Bij kans op overdracht van micro-organismen vanuit (secreet uit) de neus en/of de mond van de medewerker naar de patiënt (het chirurgisch mondneusmasker is bedoeld lucht die wordt uitgeademd te filteren van micro-organismen) 3. bij kans dat de mond en neus, door aanraken met de handen/handschoenen, in contact komen met micro-organismen die zich makkelijk kunnen nestelen in de neus en keel (bijvoorbeeld MRSA).
Tabel 1: overzicht van isolatievormen en bijbehorende maatregelen. Pt; patiënt, M; medewerker
|
Isolatie vorm
|
Voorbeeld van micro-organisme/ziektebeeld
|
Verspreidingsweg
|
Maatregelen
|
|
Contact (PLUS)
|
ESBL pos. bacterie
VRE
Pseudomonas BRMO
Rotavirus
|
Direct via handen of via omgeving
|
Pt: eenpersoonskamer
M: handschoenen, schort, bij Clostridium difficile en gastro-enteritis virussen handen wassen i.p.v. alcohol
|
|
Contact-druppel
|
RSV
Influenza
Kinkhoest
Roodvonk
|
Via druppels door hoesten / niezen over afstand van ca. 1.5 m
- direct/indirect
|
Pt: eenpersoonskamer
M: handschoenen, schort filtermasker (FFP1)
|
|
Aërogeen
|
Tuberculose
|
Via aërosolen
|
Pt: eenpersoonskamer met sluis en drukregeling (onderdruk in de kamer)
M: filtermasker (FFP2)
|
|
Strikt
|
MRSA
|
Via lucht door niezen, huidschilfers of direct/indirect
|
Pt: eenpersoonskamer met sluis en drukregeling (onderdruk in de kamer)
M: handschoenen, schort, chirurgisch mond-neus masker, muts
|
|
Strikt –
Aërogeen
|
Waterpokken
|
Via aërosolen, direct/indirect
|
Pt: eenpersoonskamer met sluis en drukregeling (onderdruk in kamer)
M: handschoenen, schort filtermasker (FFP2)
|
Beschermende isolatie
Voor patiënten die naar verwachting > 10 dagen neutropeen zijn en patiënten met brandwonden vormen micro-organismen uit de omgeving een groot infectierisico. Zij worden verpleegd in een eenpersoonskamer waarin overdruk heerst. De medewerker neemt in ieder geval algemene voorzorgsmaatregelen. Overige maatregelen verschillen per ziekenhuis en hangen o.a. af van het ziektebeeld van de patiënt.
terug naar boven
Reiniging en desinfectie
Ook reinigen en desinfecteren van oa. oppervlakten en instrumenten draagt bij aan voorkomen van transmissie van micro-organismen. Voor meer informatie omtrent dit onderwerp wordt verwezen naar de WIP-richtlijn reiniging en desinfectie.
terug naar boven
BRMO
Micro-organismen die resistent zijn tegen de eerste keuze-antibiotica of tegen meerdere groepen antibiotica en die zonder aanvullende maatregelen tot verspreiding kunnen leiden worden ‘Bijzonder Resistente Micro-Organismen (BRMO)’ genoemd. De WIP heeft criteria opgesteld wanneer een micro-organisme een BRMO wordt genoemd. Hieronder worden de verschillende BRMO’s benoemd.
terug naar boven
MRSA - Meticilline-resistente Staphylococcus aureus
Beta-lactam (o.a. flucloxacilline en cefuroxim) ongevoelige variant van de bacterie Staphylococcus aureus. Transmissie vindt plaats door direct huidcontact, maar ook via huidschilfers of via niezen. In 2011 lag de prevalentie van MRSA in de meeste Europese landen tussen de 10 en 50%, terwijl in Nederland de prevalentie in 2013 werd geschat op 1.7% (Soeverein et al, Plos One 2016). Dit is met name te danken aan het zogenaamde Nederlandse ‘search and destroy’ beleid. Dit beleid houdt in het actief screenen en isoleren van hoog risicogroepen en bekende MRSA positieve patiënten en behandeling van infectie en dragerschap door MRSA.
terug naar boven
ESBL – Extended spectrum beta-lactamase
Een ESBL is een enzym dat bepaalde soorten antibiotica (bijvoorbeeld penicillines en cefalosporines) kan afbreken. Gram-negatieve bacteriën, zoals de darmbacterie Escherichia coli (E. coli), kunnen een dergelijk ESBL enzym bezitten. Er bestaat zowel dragerschap als infectie door ESBL positieve bacteriën. Transmissie van ESBL positieve bacteriën in een zorginstelling vindt plaats door direct contact. De prevalentie van Extended Spectrum Beta-Lactamase (ESBL)-producerende Enterobacteriaceae ligt onder de 10%. Het lijkt er in Nederland niet op dat de prevalentie van ESBL significant toeneemt (NethMap, 2016).
terug naar boven
CPE – carbapenem resistente Enterobacteriaceae
De groep van Enterobacteriaceae bestaat uit meerdere gramnegatieve bacteriën samen. Onder andere de E. coli, Klebsiella en Proteus bacterie horen in deze groep. Deze bacteriën kunnen bepaalde genen (zoals OXA, NDM, KPC) bevatten die coderen voor enzymen die de ‘reserve’ carbapenem antibiotica (zoals meropenem en imipenem) afbreken. Daardoor zijn deze bacteriën resistent tegen deze antibiotica. In Nederland komen anno 2016 carbapenemase-producerende gramnegatieve bacteriën niet vaak voor. Minder dan 1% van de stammen is carbapenem resistent (RIVM website, NethMap 2016). Als carbapenemresistentie voorkomt, is dit met name bij Klebsiella-species, E. coli en Enterobacter-species. Transmissie vindt plaats door direct contact.
terug naar boven
Pseudomonas aeruginosa BRMO
Deze gram-negatieve bacterie is een bekend nosocomiaal pathogeen. P. aeruginosa is intrinsiek resistent tegen een aantal antibiotica, maar ook kan resistentie makkelijk optreden. P. aeruginosa wordt een BRMO genoemd als er sprake is van resistentie tegen 3 groepen antibiotica tegelijkertijd waar P. aeruginosa normaliter wel gevoelig voor is (ceftazidime, piperacilline, fluorquinolonen bijvoorbeeld ciproxin, aminoglycosiden bijvoorbeeld gentamicine, carbapenems). Ook als een carbapenemase-gen dat carbapenem antibiotica afbreekt wordt aangetroffen, wordt P. aeruginosa een BRMO genoemd. Het meest gevonden carbapenemase-gen in P. aeruginosa is het zogenaamde VIM gen (Verona integron-encoded metallo-β-lactamase). In 2015 was het percentage van BRMO Pseudomonas op Nederlandse IC’s 2.6%, op algemene afdelingen 1,2%, op poliklinieken 0.8% (NethMap 2016). Transmissie vindt plaats via handen, via (vochtige) omgeving of materiaal dat niet goed gereinigd is.
terug naar boven
VRE – vancomycine en amoxicilline resistente enterococcen
Enterococcen zijn gram-positieve bacteriën die in de darm voorkomen. Indien deze bacteriën een gen bevatten coderend voor vancomycine resistentie (zoals een vanA gen), wordt de bacterie resistent voor vancomycine. Er bestaat zowel dragerschap als infectie door VRE. Transmissie vindt plaats via direct contact of via handen die in aanraking zijn geweest met de patiënt of diens omgeving. De prevalentie van VRE is niet exact bekend. In 2015 zijn er in 16 Nederlandse ziekenhuizen uitbraken met VRE gerapporteerd (NethMap 2016).
terug naar boven
Overige BRMO
Door de WIP worden nog enkele micro-organismen aangemerkt als BRMO. Voor meer informatie over deze BRMO’s kan de WIP-richtlijn geraadpleegd worden.
- Enterobacteriaceae resistent voor fluorquinolonen en aminoglycosiden
- Streptococcus pneumoniae (‘pneumokok’, bekende veroorzaker van luchtweginfecties) resistent voor penicilline
- Acinetobacter species, carbapenemase positief OF resistent voor zowel aminoglycosiden en fluorquinolonen.
terug naar boven
Infectiepreventie op de kinderafdeling en NICU: een uitdaging
Bij zowel volwassenen als kinderen zijn met name bepaalde groepen patiënten at risk voor zorg gerelateerde infecties, onder andere neutropene patiënten, patiënten met intravasculaire katheters, patiënten aan beademing. Ook het verblijf in een ziekenhuis op zich, waar zich bijzonder resistente micro-organismen bevinden, vormt voor zowel kinderen als volwassenen een risico. Er zijn echter specifieke aspecten die infectiepreventie tot een uitdaging maken bij met name jonge kinderen. Het immuunsysteem van jonge kinderen is nog naïef waardoor bepaalde, in het bijzonder gastro-intestinale en respiratoire infecties, makkelijker opgelopen worden, maar ook ernstiger kunnen verlopen en de micro-organismen langer uitgescheiden kunnen worden dan op oudere leeftijd. Een kind met een community acquired infectie als respiratoir syncytieel virus, rotavirus, varicella zoster virus, mazelenvirus en kinkhoest kan makkelijk als bron dienen voor nosocomiale verspreiding tussen de andere kinderen met een nog weinig ontwikkeld immuunsysteem. Verdere uitdagingen vormen het nauwe contact tussen kinderen in gezamenlijke ruimten of tussen kinderen en bezoek. Het niet goed kunnen controleren van ontlasting, het niet goed kunnen aanleren van hygiënisch gedrag bij kinderen (zoals wassen van handen), het niet makkelijk kunnen afnemen van diagnostiek (bijvoorbeeld een keelwat) en het niet goed kunnen uitleggen aan een kind waarom deze in de eenpersoonskamer moet blijven bij isolatie vormen een risico dat er verspreiding van micro-organismen plaats vindt. Daarnaast kunnen speelgoed en knuffels een bron zijn van potentiele pathogenen. Overigens net als huisdieren, maar deze zijn over het algemeen niet toegestaan (Posfay-Barbe, 2008).
terug naar boven
Literatuur
- Gill CJ, Gilla GC. Nightingale in Scutari: Her Legacy Reexamined. Clinical Infectious Diseases 2005
- Smith PW, Watkins K, Hewlett A. Infection control through the ages. American Journal of Infection Control 2012
- Souverein D, Houtman P, Euser SM, Herpers BL, Kluytmans J, Den Boer JW. Costs and Benefits Associated with the MRSA Search and Destroy Policy in a Hospital in the Region Kennemerland, The Netherlands. PLoS ONE 2016
- Posfay-Barbe KM, Zerr DM, Pittet D. Infection control in paediatrics. Lancet Infect Dis 2008
- NethMap 2016. Consumption of antimicrobial agents and antimicrobial resistance among medically important bacteria in The Netherlands in 2015.
- Koeleman JGM, Verbrugh HA. Preventie en bestrijding van ziekenhuisinfecties: wetten, richtlijnen en organisatie. NTMM 1999
- Pittet D, Boyce JM. Handhygiene and patient care: persuing the Semmelweis legacy. Lancet Infect Dis 2001
- Larson EL, Cimiotti J, Haas J, et al. Effect on antiseptic handwashing vs alcohol sanitizer on health care-associated infections in neonatal intensive care units. Arch Pediatr Adolesc Med 2005
- Pittet D, Mourouga P, Perneger TV. Compliance with handwashing in a teaching hospital. Infection Control Program. Ann Intern Med 1999
- Mackenbach JP. Sanitation: pragmatism works. BMJ 2007
- WIP-richtlijnen: Algemene voorzorgsmaatregelen, Persoonlijke beschermingsmiddelen, BRMO, MRSA, Handhygiëne, Persoonlijke hygiëne medewerker, Isolatie, Reiniging en Desinfectie
- WHO guidelines on hand hygiene in health care. WHO. ISBN 978 92 4 159790 6.